肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS),又名“渐冻症”,也称为运动神经元病(MND)或Lou Gehrig病,是一种影响中枢和周围神经系统的慢性、进行性神经退行性疾病。ALS的主要临床表现为进行性的骨骼肌无力、肌萎缩、肌束颤动和延髓麻痹,会伴随病程发展而逐渐恶化,甚至会影响呼吸肌,导致呼吸困难。发病高峰期通常发生在45岁以上,男性发病率高于女性。
ALS的病理特征是受影响的运动神经元内会出现异常的蛋白质聚集,形成包涵体。这些包涵体的主要成分通常是TDP-43蛋白。然而,在某些遗传性ALS病例中,如果存在SOD1或FUS基因的突变,相应的包涵体则主要为SOD1蛋白或FUS蛋白。ALS研究的关键靶点主要包括SOD1、TDP-43、VCP、FUS、C9ORF72等。
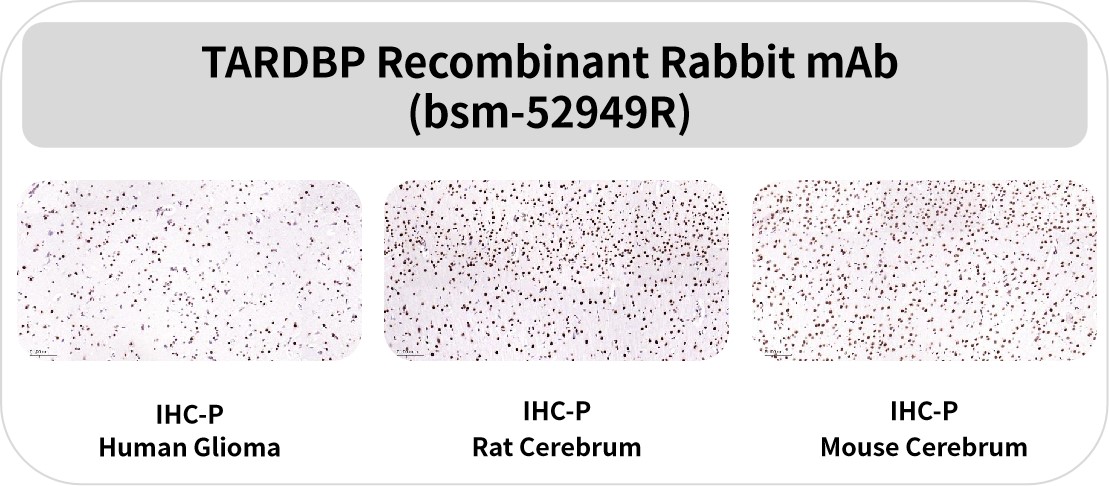
TDP-43
TDP-43蛋白在所有细胞类型中广泛表达,由TARDBP基因编码,能够与DNA和RNA进行结合,在RNA转录、选择性剪切和mRNA的稳定性调节方面都发挥着重要的功能。生理条件下,TDP-43具有核内和胞质穿梭的能力,但会优先在核内发挥功能;而在病理条件下,当发生突变或在一定的细胞应激下,TDP-43可转移到细胞质中,呈现高度磷酸化或者泛素化,导致溶解性大大降低,导致细胞毒性的产生。TDP-43蛋白质异常聚积,其在细胞质的错误定位是ALS的一个重要病理标志。
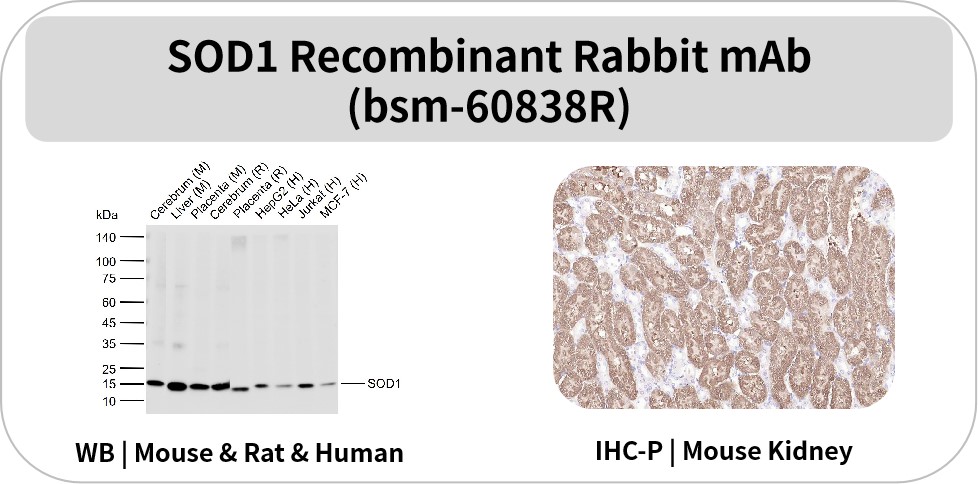
SOD1
SOD1是一种重要的抗氧化酶,属于金属酶家族,它是一种丰富的细胞质和线粒体酶,尤其在神经元中高表达,通过分解超氧化物自由基来清除超氧化物分子。SOD1是第一个在细胞外囊泡(EVs)中检测到的ALS相关蛋白。约10%的ALS病例为家族性(fALS),其中20%的fALS由SOD1基因突变引起;而散发性ALS(sALS)也可能与SOD1蛋白异常聚集有关。运动神经元中含有SOD1的细胞内包涵体是ALS的标志,但具体发病机制尚不明确。
FUS
FUS是一种DNA/RNA结合蛋白,在转录调控、前体mRNA剪接和DNA损伤反应中发挥作用。FUS的突变常见于ALS和额颞叶变性(FTLD)患者,其突变(尤其是C端PY-NLS结构域的突变)会让FUS蛋白“迷路”,无法正常进入细胞核,反而在细胞质中堆积成团。这些异常聚集的FUS蛋白像“垃圾”一样堵塞细胞,干扰正常功能。

VCP
VCP(Valosin-containing protein),也被称为p97,是三磷酸腺苷(ATP酶)AAA家族的重要保守成员,与多种细胞活性相关。它在细胞内含量丰富且结构保守,通常以同源六聚体形式存在。VCP蛋白参与了多种重要的细胞生物学过程,包括蛋白质稳态调控、自噬、染色质重塑、转录活性调节、免疫信号传导等。VCP是ALS的重要致病基因之一,其突变通过破坏蛋白质稳态、线粒体功能和内质网应激导致运动神经元死亡。

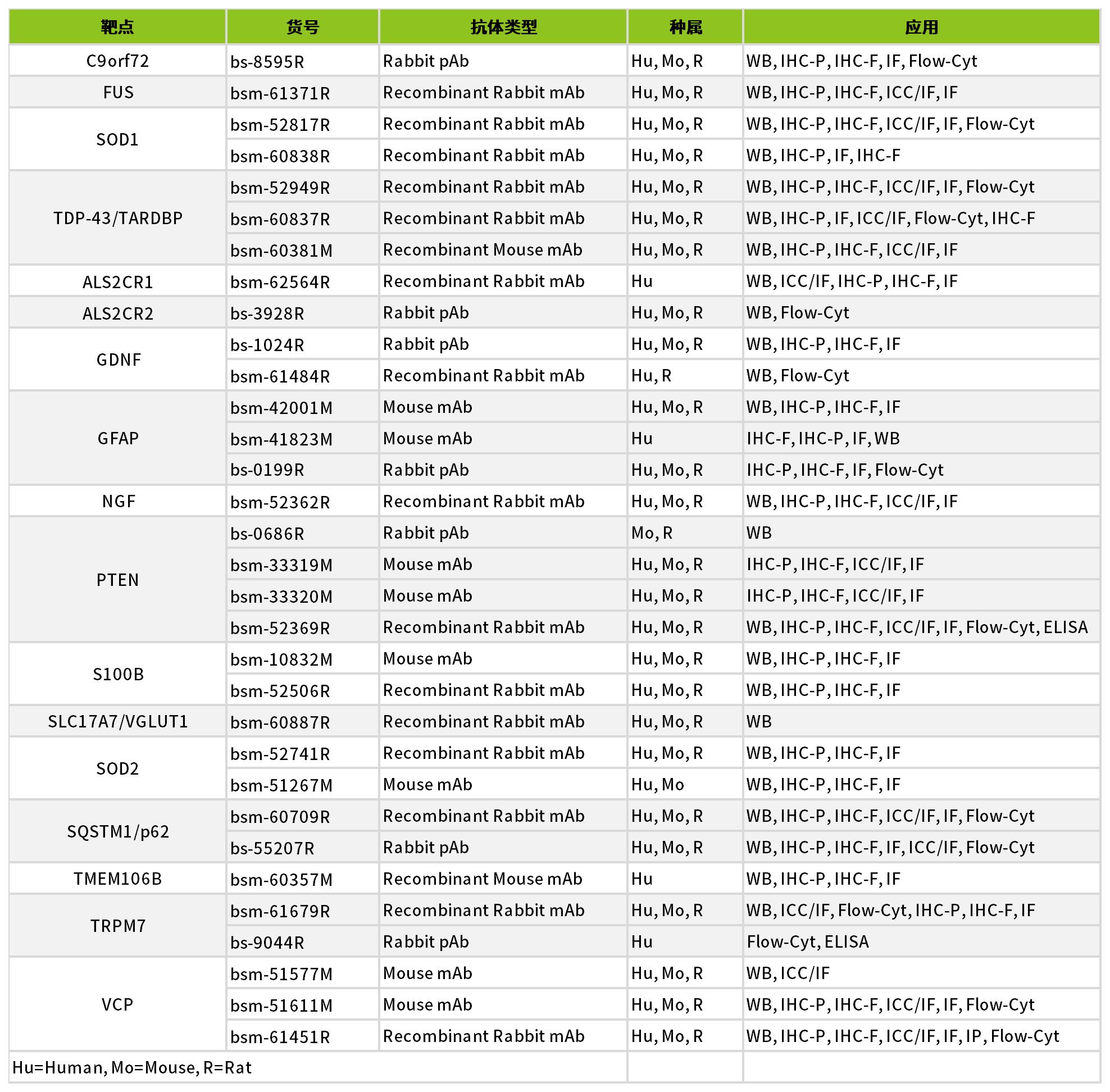
ALS热门研究靶点及优质抗体研究工具详见下表: